디지털 혁신 속도내는 서울대병원…분산형 임상시험 기술개발 돌입
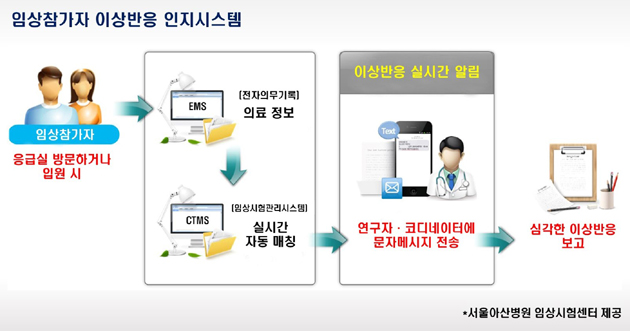
메디칼타임즈=이지현 기자서울대병원은 지난 3일 의학연구혁신센터 서성환홀에서 연구계획을 검토하고 사업 추진 의지를 다지기 위한 '분산형 임상시험 신기술 개발 연구 개시모임'을 개최했다고 8일 밝혔다.분산형 임상시험(DCT, Decentralized Clinical Trials)이란, 임상시험에 디지털 기술을 접목하여 환자가 시험기관을 직접 방문하지 않고도 임상시험 절차 대부분을 비대면으로 진행할 수 있는 방식이다.주관연구기관인 서울대병원을 비롯해 7개의 병원과 10개의 IT기업으로 구성된 컨소시엄은 금번 모임을 기점으로 원격 모니터링 등 분산형 임상시험 핵심 기술에 대한 개발연구를 본격적으로 추진한다.최첨단 기술을 확보해 분산형 임상시험의 국내 저변을 확대하고, 글로벌 수준의 임상시험 경쟁력을 갖추는 것이 목표다.분산형 임상시험 신기술 개발 연구 개시모임 기념사진. 총괄책임자 서울대병원 김경환 융합의학기술원장(오른쪽 4번째), 국가임상시험재단 박인석 이사장(오른쪽 5번째)기존 방식 대비 높은 환자 접근성과 저렴한 비용의 이점을 가진 분산형 임상시험은 최근 세계적인 트렌드로 부상했다. 특히 지난 5월 미국 FDA의 가이드라인 발표에 힘입어 분산형 임상시험 시장은 앞으로도 지속적인 성장세를 보일 것으로 기대되는 중이다.지금까지 국내 전망은 불투명했다. 2019년부터 2022년 5월까지 단일국가 기준 국내 분산형 임상시험의 비율은 1.2%인데, 이는 호주(15.1%), 영국(14.6%), 덴마크(12.9%), 뉴질랜드(12.7%), 미국(10.5%) 등 유사한 임상시험 인프라를 가진 선진국들에 비해 낮은 수치다.이에 서울대병원 컨소시엄은 지난 5월 국가임상시험지원재단이 주관한 스마트 임상시험 신기술개발 연구사업 공모에 ‘범국가 분산형 임상시험 기반 마련을 위한 원격모니터링 등 신기술 개발 및 확산 연구’ 과제로 참여, 사업 주체로 최종 선정됐다.이로써 컨소시엄은 사업비 45억을 지원받아 2027년까지 5년간 ▲임상시험 데이터웨어하우스(CTDW) 기반 원격 모니터링 요소기술 ▲환자기반 원외자료 수집 요소기술에 대한 개발 연구를 추진한다.과제의 핵심인 ‘원격 모니터링 시스템’은 이번 연구를 통해 개발되는 CTDW에 기반한다. CTDW에는 의무기록 의무기록·검사결과 등 병원 내 데이터부터 웨어러블 기기 등을 통해 수집되는 원외 데이터까지 모든 임상시험 데이터가 등재되며, 데이터를 익명화하여 의뢰자 등에게 실시간 제공할 수 있다.원외 데이터의 광범위한 수집을 위한 '환자기관 원외자료 수집 플랫폼' 개발도 함께 이뤄진다. 기 구축된 서울대병원 임상시험관리시스템과 스마트 임상시험 앱, 협력사의 웨어러블 기기 등을 CTDW에 연동하여 다량의 원외 데이터를 일목요연하게 수집·관리할 예정이다.서울대병원 컨소시엄 구성도이에 따라 원격 모니터링 기술이 실용화되면 개인정보보호 등의 규제로 실현이 어려웠던 '원격 모니터링 시스템'을 국내 최초로 구축해 기존에 시험기관을 직접 방문해 진행해야만 했던 모니터링 업무의 효율이 대폭 증진될 것으로 기대된다.추가로 본 과제에서는 분산형 임상시험을 범국가적으로 확산 적용하는 데 필요한 정책 분석 및 가이드라인 개발도 함께 진행된다.총괄연구책임자 김경환 융합의학기술원장(심장혈관흉부외과)은 "분산형 임상시험은 임상시험의 효율성을 증진하고 신약개발 기간을 단축하는 경제적 이점도 있지만, 무엇보다 환자 간 임상시험 접근성의 불평등을 해소해 환자중심 임상시험을 가능케 하는 강력한 도구라는 점에서 의미가 크다"고 말했다.그는 이어 "환자중심병원인 서울대병원은 분산형 임상시험 신기술 개발 연구를 주도하여 환자중심 임상시험 생태계를 조성하고, 디지털 의료 혁신을 달성하는 데 앞장서겠다"고 덧붙였다.